جدول تناوبی با شعاع اتمی از 0 تا 100 نکات (بالا به پایین و چپ به راست)

جهان اطراف ما از اتمها تشکیل شده است، واحدهای سازندهای که با نظم شگفتانگیزی در طبیعت کنار هم قرار گرفتهاند. جدول تناوبی، یکی از برجستهترین ابزارهای علمی، این اتمها را بر اساس ویژگیهایشان سازماندهی میکند و به ما کمک میکند تا رفتار و خواص عناصر شیمیایی را درک کنیم. یکی از مهمترین ویژگیهای اتمها، شعاع اتمی آنهاست که اندازه اتم را تعیین میکند و بر بسیاری از خواص شیمیایی و فیزیکی عناصر تأثیر میگذارد.
این مقاله با هدف ارائه یک بررسی جامع و کاربردی درباره جدول تناوبی و شعاع اتمی نوشته شده است. هدف ما این است که خواننده، حتی اگر دانش اولیه کمی در شیمی داشته باشد، بتواند با مطالعه این متن به درک عمیقی از این موضوع برسد. در ادامه، جدول تناوبی و شعاع اتمی را تعریف میکنیم، انواع شعاع اتمی را بررسی میکنیم، بزرگترین و کوچکترین شعاعهای اتمی را شناسایی میکنیم و تغییرات شعاع اتمی در جدول تناوبی را با دلایل علمی توضیح میدهیم.
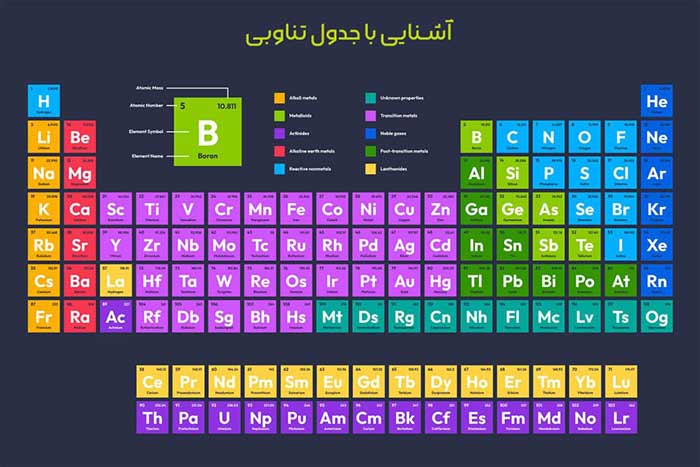
جدول تناوبی چیست؟
جدول تناوبی، که گاهی به نام جدول مندلیف نیز شناخته میشود، یک نمایش سازمانیافته از عناصر شیمیایی است که بر اساس عدد اتمی (تعداد پروتونها در هسته اتم)، آرایش الکترونی و خواص شیمیایی آنها مرتب شدهاند.
این جدول که در قرن نوزدهم توسط دیمیتری مندلیف توسعه یافت، عناصر را در ردیفهای افقی (دورهها) و ستونهای عمودی (گروهها) قرار میدهد. هر دوره نشاندهنده یک سطح انرژی الکترونی جدید است، در حالی که گروهها عناصری با خواص شیمیایی مشابه را کنار هم قرار میدهند.
مطلب پرطرفدار و فوق کاربردی سایت! آموزش تصویری تندخوانی 0 تا 100 و تکنیکها+ PDF رایگان
جدول تناوبی استاندارد شامل 118 عنصر شناختهشده است که از هیدروژن (با عدد اتمی 1) شروع میشود و تا اوگانسون (با عدد اتمی 118) ادامه مییابد. این جدول به چهار بلوک اصلی تقسیم میشود:
- بلوک s: شامل فلزات قلیایی و قلیایی خاکی (گروههای 1 و 2).
- بلوک p: شامل نافلزات، هالوژنها و گازهای نجیب (گروههای 13 تا 18).
- بلوک d: شامل فلزات واسطه (گروههای 3 تا 12).
- بلوک f: شامل لانتانیدها و آکتینیدها.
این ساختار به دانشمندان امکان میدهد تا روندهای تناوبی مانند تغییرات شعاع اتمی، الکترونگاتیوی، و انرژی یونش را بررسی کنند. جدول تناوبی نه تنها ابزاری برای شیمیدانان است، بلکه در فیزیک، زیستشناسی و مهندسی نیز کاربردهای گستردهای دارد.
حجم: 2 مگابایت
سطح: از صفر تا صد
شعاع اتمی چیست؟
شعاع اتمی به اندازه یک اتم اشاره دارد و معمولاً به عنوان فاصله بین مرکز هسته اتم تا بیرونیترین لایه الکترونی تعریف میشود. با این حال، از آنجا که الکترونها در ابرهای الکترونی با مرزهای نامشخص حرکت میکنند، تعیین دقیق شعاع اتمی چالشبرانگیز است. به همین دلیل، شعاع اتمی اغلب به صورت نصف فاصله بین هستههای دو اتم مشابه در یک پیوند شیمیایی (مانند پیوند کووالانسی) اندازهگیری میشود. این مقدار بر حسب پیکومتر (pm) یا آنگستروم (Å) بیان میشود (1 Å = 100 pm).
شعاع اتمی یک ویژگی کلیدی است زیرا بر خواص شیمیایی و فیزیکی عناصر، مانند واکنشپذیری، نوع پیوندهای شیمیایی، و حتی چگالی مواد تأثیر میگذارد. برای مثال، اتمهای بزرگتر معمولاً واکنشپذیرتر هستند، زیرا الکترونهای بیرونی آنها از هسته دورترند و راحتتر جدا میشوند.
مطلب پرطرفدارسایت آموزش صفر تا صد زبان انگلیسی+ جزوه PDf!
انواع شعاع اتمی
شعاع اتمی بسته به نوع پیوند یا حالت اتم میتواند به چند شکل تعریف شود. در ادامه، انواع اصلی شعاع اتمی را بررسی میکنیم:
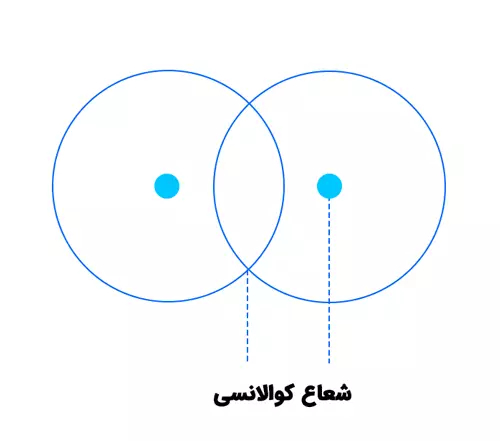
شعاع کووالانسی:این نوع شعاع برای اتمهایی که با پیوند کووالانسی به هم متصلاند تعریف میشود. شعاع کووالانسی نصف فاصله بین هستههای دو اتم مشابه در یک مولکول است. برای مثال، در مولکول Cl₂، فاصله بین دو هسته کلر حدود 198 پیکومتر است، بنابراین شعاع کووالانسی کلر حدود 99 پیکومتر خواهد بود.
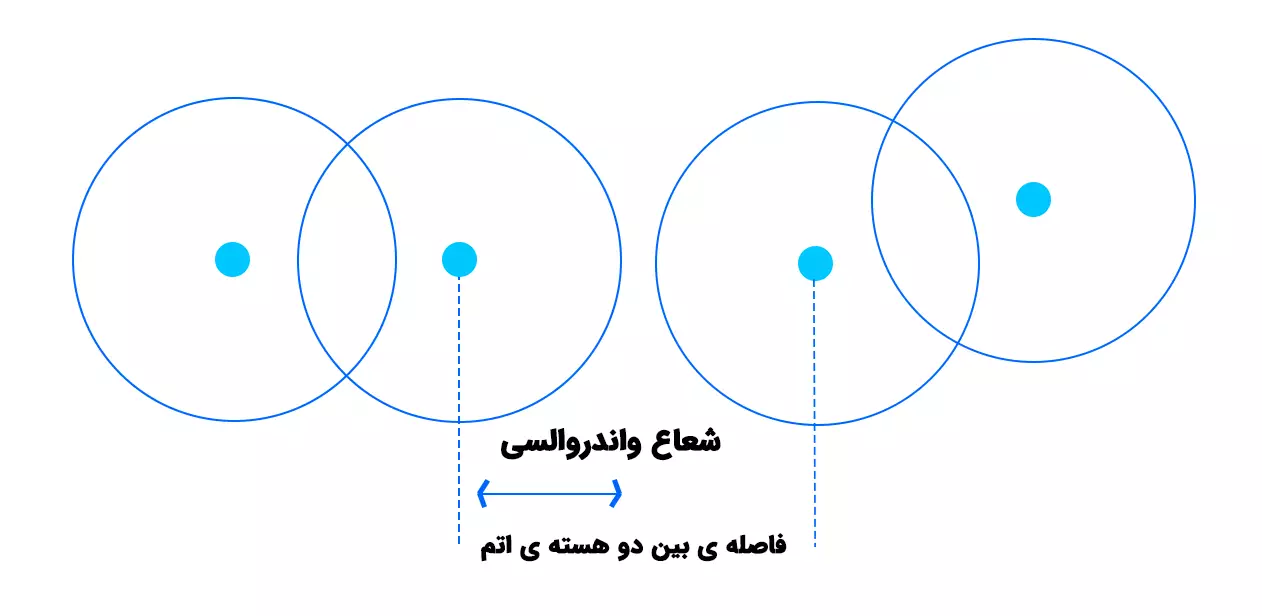
:شعاع واندروالسی برای اتمهایی که با یکدیگر پیوند شیمیایی ندارند (مانند اتمهای گازهای نجیب در حالت جامد) تعریف میشود. این شعاع نصف فاصله بین هستههای دو اتم غیرپیوندی است که در تماس نزدیک با یکدیگر قرار دارند. شعاع واندروالسی معمولاً بزرگتر از شعاع کووالانسی است، زیرا شامل فضای بیشتری از ابر الکترونی میشود.
مهارتی که واسه کنکوری ها فوق العاده مهمه! آموزش خلاصه نویسی و نکته برداری صفر تا صد+ نکات و ترفندها
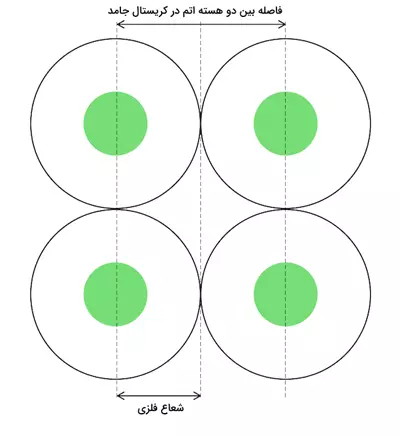
:این نوع شعاع برای اتمهای فلزی در یک شبکه بلوری فلزی تعریف میشود. شعاع فلزی نصف فاصله بین هستههای دو اتم مجاور در ساختار بلوری فلز است. این شعاع معمولاً برای فلزات قلیایی و قلیایی خاکی بزرگتر است.
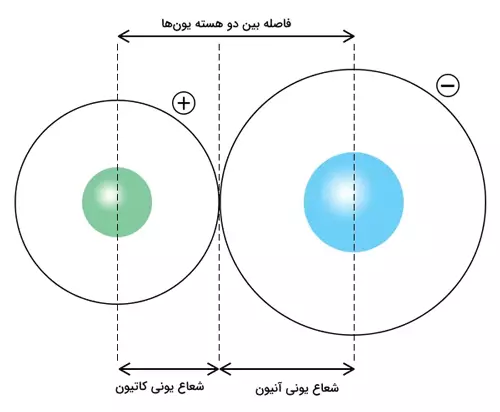
:شعاع یونی به اندازه یونهای یک عنصر اشاره دارد. وقتی اتم الکترون از دست میدهد و به کاتیون تبدیل میشود، شعاع آن کاهش مییابد، زیرا تعداد الکترونهای باقیمانده کمتر است و هسته با نیروی بیشتری الکترونها را جذب میکند. برعکس، وقتی اتم الکترون میگیرد و به آنیون تبدیل میشود، شعاع آن افزایش مییابد، زیرا دافعه بین الکترونها بیشتر میشود.
:شعاع بور یک تعریف خاص برای اتم هیدروژن است و به فاصله محتملترین مکان الکترون از هسته در حالت پایه اشاره دارد. این مقدار حدود 53 پیکومتر است و به عنوان یک ثابت فیزیکی شناخته میشود.
هر یک از این تعاریف بسته به زمینه کاربردشان (مانند شیمی آلی، شیمی معدنی، یا فیزیک حالت جامد) اهمیت خاص خود را دارند.
تغییرات شعاع اتمی در جدول تناوبی
شعاع اتمی در جدول تناوبی به صورت منظم و قابل پیشبینی تغییر میکند. این تغییرات به دو جهت اصلی بررسی میشوند: از چپ به راست در یک دوره (ردیف افقی) و از بالا به پایین در یک گروه (ستون عمودی). در ادامه، این تغییرات را با دلایل علمی توضیح میدهیم.
ترفندی که یه عمر به کارت میاد! 7 بهترین سایت آنلاین افزایش کیفیت عکس (هوش مصنوعی)
تغییرات شعاع اتمی از چپ به راست در یک دوره
وقتی در یک دوره از چپ به راست حرکت میکنیم (مثلاً از سدیم به آرگون در دوره 3)، شعاع اتمی به طور کلی کاهش مییابد. دلایل این کاهش عبارتاند از:
- افزایش بار هستهای:با حرکت از چپ به راست، عدد اتمی افزایش مییابد، یعنی تعداد پروتونها در هسته بیشتر میشود. این افزایش بار هستهای باعث میشود که الکترونها با نیروی بیشتری به سمت هسته کشیده شوند.
- ثابت ماندن تعداد لایههای الکترونی:در یک دوره، تمام عناصر دارای تعداد یکسانی لایه الکترونی هستند. برای مثال، در دوره 3، همه عناصر الکترونهای خود را در لایههای 1، 2 و 3 قرار میدهند. بنابراین، اضافه شدن الکترونها به همان لایه خارجی باعث افزایش دافعه بین الکترونها میشود، اما این اثر به اندازه افزایش جاذبه هستهای قوی نیست.
- افزایش بار مؤثر هسته (Z_eff):بار مؤثر هسته، نیروی خالصی است که الکترونهای لایه خارجی از هسته احساس میکنند. با افزایش تعداد پروتونها و ثابت ماندن اثر پوششی الکترونهای داخلی، بار مؤثر هسته افزایش مییابد و الکترونها به هسته نزدیکتر میشوند، که منجر به کاهش شعاع اتمی میشود.
مثال: در دوره 3، شعاع اتمی سدیم (Na) حدود 154 پیکومتر است، در حالی که شعاع اتمی کلر (Cl) حدود 99 پیکومتر است. این کاهش به دلیل افزایش بار هستهای از 11 پروتون در سدیم به 17 پروتون در کلر است.
استثناها:
در برخی موارد، مانند فلزات واسطه یا عناصر گروه 13 و 14، ممکن است استثناهایی در روند کاهش شعاع مشاهده شود. برای مثال، شعاع اتمی گالیم (Ga) کمی کوچکتر از آلومینیوم (Al) است، به دلیل اثر انقباض d-اوربیتالها که بار مؤثر هسته را افزایش میدهد.
تغییرات شعاع اتمی از بالا به پایین در یک گروه
وقتی در یک گروه از بالا به پایین حرکت میکنیم (مثلاً از لیتیم به سزیم در گروه 1)، شعاع اتمی به طور کلی افزایش مییابد. دلایل این افزایش عبارتاند از: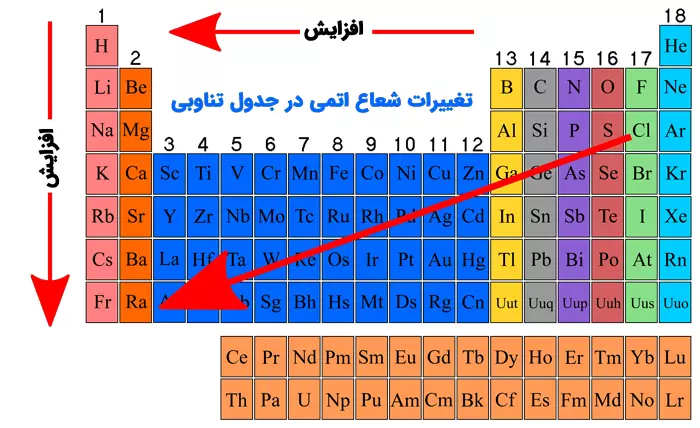
افزایش تعداد لایههای الکترونی:
با حرکت به سمت پایین در یک گروه، تعداد لایههای الکترونی افزایش مییابد. برای مثال، لیتیم (Li) دارای 2 لایه الکترونی است، در حالی که سزیم (Cs) 6 لایه دارد. این لایههای اضافی فاصله بین هسته و الکترونهای بیرونی را افزایش میدهند.
افزایش اثر پوششی:
الکترونهای داخلی (لایههای نزدیکتر به هسته) جاذبه هسته را برای الکترونهای بیرونی کاهش میدهند، پدیدهای که به عنوان اثر پوششی شناخته میشود. با افزایش تعداد لایههای الکترونی، اثر پوششی قویتر میشود و الکترونهای بیرونی کمتر به هسته جذب میشوند.
سایتهای فوق کاربردی : 5 سایت تبدیل صدا به متن و برعکس (هوش مصنوعی)
کاهش بار مؤثر هسته:
اگرچه تعداد پروتونها با حرکت به پایین افزایش مییابد، اثر پوششی الکترونهای داخلی باعث میشود که بار مؤثر هسته برای الکترونهای بیرونی کاهش یابد. این امر باعث میشود که الکترونها در فاصله دورتری از هسته قرار گیرند.
مثال: در گروه 1، شعاع اتمی لیتیم (Li) حدود 152 پیکومتر است، در حالی که شعاع اتمی سزیم (Cs) حدود 265 پیکومتر است. این افزایش به دلیل اضافه شدن لایههای الکترونی و اثر پوششی قویتر در سزیم است.
استثناها:
در فلزات واسطه یا لانتانیدها، ممکن است روند افزایش شعاع اتمی به دلیل انقباض لانتانیدی (اثر پر شدن اوربیتالهای f) کمی متفاوت باشد. برای مثال، شعاع اتمی در سری لانتانیدها به طور قابلتوجهی کاهش مییابد.
بزرگترین و کوچکترین شعاع اتمی در جدول تناوبی
در جدول تناوبی، اندازه شعاع اتمی به طور قابلتوجهی بین عناصر مختلف متفاوت است. به طور کلی، بزرگترین شعاع اتمی متعلق به عناصری است که در پایین و سمت چپ جدول تناوبی قرار دارند، در حالی که کوچکترین شعاع اتمی در بالا و سمت راست جدول یافت میشود.
بزرگترین شعاع اتمی:
عنصر سزیم (Cs)، که در گروه 1 (فلزات قلیایی) و دوره 6 قرار دارد، بزرگترین شعاع اتمی را در جدول تناوبی دارد. شعاع کووالانسی سزیم حدود 265 پیکومتر است. دلیل این اندازه بزرگ، وجود لایههای الکترونی متعدد (6 لایه اصلی) و اثر پوششی قوی الکترونهای داخلی است که جاذبه هسته را بر الکترونهای بیرونی کاهش میدهد.
کوچکترین شعاع اتمی:
عنصر هلیوم (He)، که در گروه 18 (گازهای نجیب) و دوره 1 قرار دارد، کوچکترین شعاع اتمی را دارد. شعاع کووالانسی هلیوم حدود 31 پیکومتر است. این اندازه کوچک به دلیل تعداد کم لایههای الکترونی (فقط یک لایه) و بار هستهای بالا (دو پروتون) است که الکترونها را به شدت به سمت هسته میکشد.
این تفاوتها در شعاع اتمی نشاندهنده روندهای منظم در جدول تناوبی هستند که در بخشهای بعدی به طور مفصل بررسی میشوند.
چرا درک شعاع اتمی مهم است؟
درک شعاع اتمی به ما کمک میکند تا خواص شیمیایی و فیزیکی عناصر را بهتر پیشبینی کنیم. در ادامه، برخی از کاربردهای شعاع اتمی را بررسی میکنیم:
- واکنشپذیری:اتمهای با شعاع بزرگتر (مانند فلزات قلیایی) معمولاً واکنشپذیرترند، زیرا الکترونهای بیرونی آنها راحتتر جدا میشوند. برعکس، اتمهای با شعاع کوچکتر (مانند هالوژنها) تمایل بیشتری به جذب الکترون دارند.
- پیوندهای شیمیایی:شعاع اتمی بر طول و قدرت پیوندهای شیمیایی تأثیر میگذارد. برای مثال، در مولکولهای کووالانسی، اتمهای با شعاع کوچکتر پیوندهای کوتاهتر و قویتری تشکیل میدهند.
- خواص فیزیکی:شعاع اتمی بر چگالی، نقطه ذوب، و نقطه جوش مواد تأثیر میگذارد. فلزات با شعاع بزرگتر معمولاً چگالی کمتری دارند، در حالی که نافلزات با شعاع کوچکتر چگالی بالاتری دارند.
بلد باشید یک عمر بدردتون میخوره روش کاهش ده برابری حجم ویدیوها بدون تغییر کیفیت!
نکات تکمیلی و پاسخ به سوالات احتمالی
برای اطمینان از جامعیت این مقاله، به برخی سوالات احتمالی که ممکن است برای خوانندگان پیش بیاید پاسخ میدهیم:
چرا شعاع اتمی در فلزات واسطه روند متفاوتی دارد؟
در فلزات واسطه، الکترونها به اوربیتالهای d اضافه میشوند که اثر پوششی کمتری نسبت به اوربیتالهای s و p دارند. این امر باعث افزایش بار مؤثر هسته و کاهش شعاع اتمی میشود، حتی با افزایش عدد اتمی.
آیا شعاع اتمی در شرایط مختلف تغییر میکند؟
بله، شعاع اتمی میتواند بسته به نوع پیوند (کووالانسی، یونی، یا فلزی) یا حالت اتم (خنثی یا یونیزه) تغییر کند. برای مثال، شعاع یونی کاتیونها کوچکتر و آنیونها بزرگتر از اتم خنثی است.
چگونه شعاع اتمی اندازهگیری میشود؟
شعاع اتمی معمولاً با روشهای تجربی مانند پراش اشعه ایکس یا محاسبات نظری بر اساس مدلهای کوانتومی تعیین میشود. این روشها فاصله بین هستهها را در ساختارهای بلوری یا مولکولی اندازهگیری میکنند.
نتیجهگیری
جدول تناوبی و شعاع اتمی دو مفهوم کلیدی در شیمی هستند که به ما کمک میکنند تا نظم و رفتار عناصر شیمیایی را درک کنیم. جدول تناوبی با سازماندهی عناصر بر اساس عدد اتمی و خواص شیمیایی، بستری برای بررسی روندهای تناوبی مانند شعاع اتمی فراهم میکند.
شعاع اتمی، به عنوان معیاری از اندازه اتم، تحت تأثیر عواملی مانند بار هستهای، تعداد لایههای الکترونی، و اثر پوششی قرار دارد. با حرکت از چپ به راست در یک دوره، شعاع اتمی کاهش مییابد، در حالی که از بالا به پایین در یک گروه افزایش مییابد.
دانلود کنید: 12 اپلیکیشن برتر آموزش زبان انگلیسی
این روندها، همراه با انواع شعاع اتمی (کووالانسی، واندروالسی، فلزی، یونی، و بور)، درک ما را از خواص شیمیایی و فیزیکی عناصر عمیقتر میکنند. امیدواریم این مقاله با زبانی ساده و ساختاری منسجم، اطلاعات جامعی را در اختیار شما قرار داده باشد و به تمامی سوالاتتان پاسخ داده باشد.